Profesor Instructor de la Cátedra de Neurocirugía, Hospital Universitario de Caracas, Venezuela
Introducción. En la actualidad el tratamiento del dolor crónico es multimodal y la neuroestimulación espinal es una de las herramientas para su manejo. Objetivo: evaluar los resultados de esta terapéutica en pacientes operados desde 1998 al 2012. Material y métodos: Se incluyeron16 pacientes con dolor neuropático crónico intratable de diferente etiología. Se tomó en cuenta la respuesta al dolor, medida con la escala visual analógica (EVA), comparando el valor inicial con los valores a los 3 y 6 meses de tratamiento, mejoría en la calidad de vida (la incorporación al trabajo, disminución de la dosis de analgésicos después de la intervención). Se evaluaron otros parámetros como: complicaciones quirúgicas, variaciones de la respuesta a la estimulación en el tiempo y tiempo de duración de la batería del marcapasos. Resultados: La escala visual analógica mostró una mejoría de los pacientes sometidos a este procedimiento, presentaron valores preoperatorios de EVA entre 7 y 10 puntos, con un promedio de 8,56 puntos, y una DS+/- 0,89; la evaluación con la misma escala a los 3 meses mostró una reducción del dolor que se mantenía en el rango de 2-6 puntos con un valor promedio de 3,31 puntos DS +/- 1,13. Esto representa una caída de 5,25 puntos de promedio en los primeros 3 meses ( p<0,00001). La medición a los 6 meses mostró un rango de EVA de 1 a 6 puntos con un promedio de 2,87 puntos DS+/- 1,25 puntos; cuando se compara el valor promedio de de caída a los 3 – 6 meses se encuentra que disminuyó en 0,43 puntos con una p= 0,23. De los 16 pacientes 12 (75%) se incorporaron a actividades, 14 pacientes requirieron menos de la mitad de la dosis de analgésicos previa a la cirugía. Se presentaron 2 tipos de complicaciones: migración del electrodo en 2 pacientes (12,5 %) e infección del marcapaso en 1 (6,25%). El promedio de duración de la batería fue de 3,4 años y hubo necesidad de aumentar el voltaje respecto al inicial. Conclusión: Los resultados de este estudio son comparables con los reportados por otros autores. Es un procedimiento no ablativo, reversible que puede ser utilizado en el manejo del dolor crónico intratable cuando se hace una buena selección de los pacientes. RCM 2014; 141(2):12-27.
Palabras clave: Dolor crónico, estimulador medular, marcapaso espinal, neuromodulación.
Background: currently the treatment of chronic pain is multimodal and spinal cord stimulation is one of the tools for the management. Objectives: to evaluate this treatment in patients who were operated between 1998 and 2012. Methods: Sixteen patients with chronic intractable pain of different etiologies were included. Response to pain, measured with the Analogical Visual Scale (VAS), comparing the initial score with the same after 3 and 6 months of treatment measuring improvement of life quality by return to work and decrease of analgesics dosage. Other parameters evaluated were surgical complications, variability in response and duration of the battery. Results: The VAS showed improvement of these patients. The average preoperative score was 8,56 points ; the evaluation with the same method showed a decrease of pain after three months of 3,3 points with SD of 1,13. This represents an average reduction of 5,25 points in the first three months (p<0,00001). The measurement at 6 months showed an average AVS of 1- 6 points with an average of 2,87 and DS+/- 1,25. Twelve patients (75 %) returned to their normal activities; 14 needed less than half of the analgesics they had taken preoperatively. There were 2 types of complications: migration of the electrode in 2 patients (12,5 %) and infection of the pacemaker in one of them ( 6,25 %) The average duration of the battery was 3,4 years and the voltage had to be increased after initiation. Conclusion: the results of this study are comparable to others. This is a non ablative, reversible procedure that can be used in the management of intractable chronic pain, when there is an adequate selection of the patients. RCM 2014; 141(2):12-27.
Key words: Chronic pain, spinal stimulator, spinal pacemaker, neuromodulation.
El dolor es un mecanismo de defensa del organismo, necesario para la supervivencia, pero cuando este se transforma en crónico representa un grave problema de salud con repercusiones económicas. La Asociación Internacional para el Estudio del Dolor (IASP, International Association for the Study of Pain) ha definido a esta sensación como una experiencia sensorial y emocional desagradable, asociada a un daño tisular real o potencial, que suele describirse en términos de la misma.
El dolor que tiene sentido biológico, también se conoce como dolor nociceptivo, ya que ocurre como consecuencia de la activación de los nociceptores (receptores para el dolor)
Dolor Nociceptivo - dolor que puede ser provocado por daño tisular, lesión, enfermedad o cirugía reciente y que por lo general se asocia a signos de inflamación.
Dependiendo de su origen se divide en somático superficial (tegumentos), somático profundo (fascias, músculos tendones, ligamentos) y visceral.
La percepción del dolor nociceptivo implica tres procesos:
Es el proceso de activación de los nociceptores, representado en las terminaciones nerviosas libres de las prolongaciones periféricas amielínicas (fibras C) y de las mielínicas finas (fibras A delta) de las pequeñas neuronas ubicadas en el ganglio dorsal de la raíz.
Es cuando los estímulos mecánicos, térmicos o químicos nociceptivos, se convierten en potenciales de acción.
Es el proceso de conducción de los impulsos nocivos generados en los nociceptores, vía nervios periféricos, médula, tronco cerebral, tálamo y radiaciones talámicas proyectadas hasta la corteza cerebral.
Existen dos vías nociceptivas que se originan en la médula: 1.-Lateral, 2.- Medial.
Las vías laterales son filogenéticamente más recientes, son cruzadas y se relacionan con el componente sensitivo-discriminativo del dolor. Permiten identificar al estimulo como doloroso, su calidad, localización, duración, intensidad. El tracto más representativo corresponde al espino-talámico lateral, que cursa por el cordón dorso lateral de la médula espinal, lemniscoespinal, núcleo postero-lateral del tálamo y porción ventro-medial del tálamo, de donde se proyecta a la corteza cerebral somatoestésica.
Las vías del grupo medial son filogenéticamente más antiguas, carecen de organización somato-tópica, la gran mayoría se decusa y parte de ellas finalizan directamente en los núcleos mediales del tálamo, sobre todo en el núcleo centro-mediano y para-fasicular, mientras que otra parte hace sinapsis en la sustancia reticular del tronco cerebral de donde parten eferencias al sistema límbico e hipotálamo. Este tipo de dolor representa un dolor amplio impreciso, referido como ardor u hormigueo. Está implicado, sobre todo, con el aspecto afectivo- emocional del dolor y se conduce por los tractos espino-retículo- talámico.
Además de las vías de transmisión del dolor existen centros y vías que suprimen el dolor y a esto es que se llama modulación.
El primer sistema de modulación del dolor, fue descrito por Melzack y Wall en 1965 (Teoría de la Compuerta), según el cual la activación de las fibras gruesas mielínicas (responsables de la conducción del tacto, presión, vibración y de la propiocepción) determina la excitación de inter-neuronas del asta dorsal, que promueve la inhibición pre-sináptica de los impulsos aferentes de los nociceptores, cerrando la compuerta y obstaculizando el pasaje de impulsos nociceptivos.
Una serie de estudios ha demostrado que la analgesia depende de la activación de núcleos como el locus coeruleus y de núcleos del bulbo (núcleos del Rafe medio, magnocelular y paragigantocelular lateral) de donde parten vías descendentes inhibitorias, noradrenérgicas y serotoninérgicas, cursando por los fascículos dorso-laterales de la médula hasta alcanzar neuronas nociceptivas situadas en el asta dorsal.
De lo anterior se deduce que la percepción final del dolor depende del equilibrio entre los sistemas de transmisiónmodulación, del aprendizaje, la memorización de las experiencias previas, grado de atención o distracción, estado emocional y del procesamiento e integración de las diversas informaciones sensoriales y cognitivas que acompañan al fenómeno doloroso.
Por lo general, el dolor agudo cede una vez que se trata o resuelve la causa principal o subyacente de la enfermedad.
La activación del sistema de alarma fuera del contexto “normal” puede provocarse a consecuencia de daños en el sistema nervioso periférico (SNP), o de daños en el sistema nervioso central (SNC). El dolor que se produce en tales situaciones ha sido definido como dolor neuropático,
El dolor neuropático puede ser desencadenado por diferentes tipos de daños, los cuales incluyen: daño directo al nervio, daño medular, accidente cerebro vascular, esclerosis múltiple, siringomielia, Herpes Zoster, HIV, daño producido por compresión radicular por hernia discal o fibrosis después de una cirugía de columna, o puede estar asociado a progresión del cáncer o post radioterapia; también puede ser inducido por fármacos y trastornos metabólicos como la neuropatía diabética.
Clínicamente se manifiesta por lo menos por uno de los siguientes tres componentes:
El dolor intermitente corresponde al de la neuralgia del trigémino, descrito como dolor paroxístico de choque eléctrico, agudo, punzante, que dura segundos o escasos minutos y aparece varias veces al día, se ve en lesiones parciales del espinotalámico y mejora con la interrupción completa del tracto espinotalámico.
El dolor evocado, a semejanza del intermitente, también ocurre en áreas parcialmente desconectadas y puede ser suprimido por la interrupción completa de la vía neoespinotalámica. Dependientes de la activación periférica de mecano o nociceptores, los impulsos generados, en virtud de los cambios sinápticos secundarios a la lesión neural, serian procesados de manera anormal en el sistema nervioso central, produciendo esta modalidad dolorosa, con posterioridad a la desconexión producida, ocurren una serie de alteraciones a nivel del sitio de la lesión:
Se define como crónico el dolor que persiste durante semanas, meses e incluso años. El dolor supera a los demás síntomas y puede convertirse en el problema principal. Puede afectar a las personas de tal modo que a menudo no pueden trabajar, pierden el apetito y no pueden realizar actividades físicas de ningún tipo, ya que éstas resultan extenuantes y agravan su dolor.

El dolor crónico, en un problema serio que muchas veces se hace resistente a los diferentes tratamientos médicos o quirúrgicos, no existe un método único que pueda erradicar consistente y permanentemente el dolor. Con frecuencia estos pacientes presentan limitaciones funcionales mucho más severas que la que se pudiera predecir por la patología de base.
En muchas oportunidades el manejo del dolor crónico agota las posibilidades farmacológicas y en ese momento se debe pensar en otras posibilidades, dentro de las cuales están las quirúrgicas, que van desde los procedimientos no ablativos hasta los ablativos. Dentro de los no ablativos la neuromodulación es uno de ellos.
La Neuromodulación es la capacidad de modular o modificar el funcionamiento del sistema nervioso utilizando estímulos eléctricos, químicos, etc., Los marcapasos espinales utilizan este concepto para modificar la percepción del dolor crónico.
La estimulación de los cordones posteriores es una herramienta útil para el control del dolor crónico, es no destructiva y es reversible en pacientes bien seleccionados, en la medida que en los cordones posteriores se encuentran gran cantidad de fibras aferentes, de fácil acceso, pues al colocar electrodos en el espacio epidural se puede lograr la estimulación de las mismas.
Se considera actualmente que los estimuladores espinales en pacientes bien seleccionados (Tabla 2) y colocados por manos con experiencia:

La efectividad es de 60-70%, es muy buena, si se considera que está indicada en pacientes en los que han fallado todas las medidas convencionales de alivio del dolor.
El dolor crónico se refiere a aquel que persiste en el tiempo de manera prolongada, independientemente de la etiología.
A nivel de los cordones posteriores se encuentran gran cantidad de vías aferentes de fácil acceso, por lo que se colocan electrodos epidurales para lograr su estimulación.
Esto se basa en la teoría de Melzack y Wall o teoría de la compuerta donde un estímulo doloroso es conducido por la fibras A-delta y C y estas pueden ser inhibidas por la activación de las fibras aferentes de gran diámetro, que al ser estimuladas producen a nivel medular, cierre de la compuerta de trasmisión de la señales dolorosas.
Wall y Sweet desarrollaron la teoría de la estimulación eléctrica medular, para manipular la compuerta y producir analgesia. Para demostrar la teoría experimentaron en ellos mismos en 1967, estimulando los nervios periféricos de la raíz dorsal de la medula.
Shearly fue el primero que propuso el uso de la electricidad para el manejo del dolor intratable. Basado en que las fibras grandes son estimuladas más fácilmente que las fibras delgadas y que de esta manera podía controlar la compuerta. Inicialmente se realizaba una micro-laminectomía para colocación de los electrodos pero actualmente se hace por punción. La analgesia producida por el estimulador no se revierte con Naloxona, por lo tanto no es mediada por endorfinas; probablemente se produce por aumento de GABA aun cuando existe aumento de sustancia P, Serotonina, Glicina y Adenosina.,
Los estudios en ratas con microdiálisis muestran aumento local GABA con la estimulación medular.
La respuesta analgésica por el aumento de GABA se puede bloquear con Bicuculina, antagonista de GABA.
La estimulación espinal reduce la hiperexcitabilidad del asta posterior de la médula, por liberación de GABA, Sustancia P, 5 HT, glicina y adenosina, reduciendo la liberación de glutamato y aspartato por acción de estimulación de receptores GABA-b. El mismo efecto se obtiene por activación de receptores GABA-b que Adenosina A-1.
En las capas profundas del asta posterior de las ratas se encuentra aumento de la tasa espontánea de disparo de las neuronas a diferentes estímulos mecánicos, térmicos y químicos cuando existe lesión del nervio ciático; cuando se estimula la médula, estos cambios desaparecen.
En animales con lesión de las columnas posteriores de la médula este efecto disminuye. Esto sugiere que parte del efecto de la estimulación medular se lleva a cabo por las columnas posteriores. Si existe una sección medular por encima del nivel de la estimulación, los efectos de la estimulación aun se reducen más. De tal manera que existen mecanismos supra-espinales y segméntales involucrados en el proceso de analgesia. Existen trabajos que muestran activación del tallo cerebral en los núcleos pretectales con la estimulación espinal; esto demuestra que existen vías inhibitorias descendentes que participan en el control del dolor por parte de los estimuladores.
En modelos animales se ha encontrado que cuando en las células del asta posterior se estimulan las láminas I, II, III y existe inhibición de las láminas IV-V, ocurre bloqueo de la conducción en el tracto espino talámico.
Existe evidencia que la estimulación de baja intensidad es capaz de modular el dolor y no bloquear la conducción del tacto.
Existen mecanismos supraespinales, por vía espinotalámica, tálamo-corticales, tálamo-bulbares que llevarían a un bloqueo prolongado en la conducción del estímulo, aunque se ha reportado que la modulación del dolor mediado por estimulación espinal no es dependiente del bloqueo del tracto, sino de la activación del sistema supraespinal de las células del núcleo dorsal del rafe y células del fascículo dorsolateral; de igual manera se propone el bloqueo mediado por células del núcleo pretectal anterior llevaría a un bloqueo prolongado en la conducción del estimulo.
Se ha encontrado evidencia que la estimulación por períodos de tan solo 30 min puede lograr periodos de analgesia prolongados.
Los estudios de RM cerebral funcional muestran que al activar el marcapaso a nivel cerebral se observa marcada desactivación bilateral del tálamo medial y de sus conexiones rostrales y caudales a la corteza del girus cíngulo y de la ínsula.
En el LCR se ha demostrado aumento de GABA posterior a la estimulación, y que el aumento de GABA inhibe la producción glutamato y aspartato que son mediadores pro álgidos, modulando de esta manera la transmisión nociceptiva
La estimulación eléctrica de la médula depende de la conductividad de los elementos intraespinales en relación a la ubicación de los electrodos. Si la neurona se hace más positiva o despolariza se producirá un potencial de acción. Para que un electrodo produzca este efecto debe estar cargado negativamente (cátodo). Cuando la neurona está cargada más negativamente su capacidad de propagar el potencial es más limitado, un electrodo positivo o ánodo produce este efecto. De tal manera que un electrodo negativo estimula mientras que un electrodo positivo evita la estimulación.
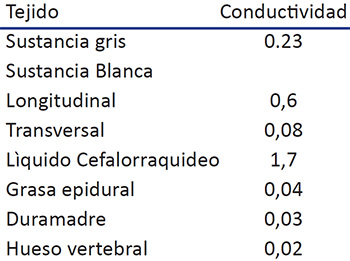
El liquido cefalorraquídeo es el elemento que mejor conduce la electricidad, le sigue la sustancia blanca pero en sentido longitudinal de las fibras, la duramadre tiene una baja conductividad al igual que la grasa epidural; esto hace que en la región dorsal, donde hay más grasa, se requiera más corriente que en la cervical ,donde la cantidad es menor. La duramadre es muy fina y esto no produce problemas. El hueso es de baja conductividad y hace que las estructuras vecinas se protejan del estimulo eléctrico. (Tabla 3)
Las fibras nerviosas de gran diámetro son muy sensibles a la estimulación eléctrica del cátodo. De esta manera a una amplitud de estimulación adecuada se pueden activar selectivamente estas fibras bloqueando la compuerta.
Los estimuladores funcionan en dolor crónico mas no funcionan en dolor agudo, y tienen mejor efecto en alodinia y sensación urente. El periodo de inicio del alivio comienza minutos después de la estimulación y su máximo efecto se puede lograr en meses. El periodo de alivio puede durar minutos u horas después de la estimulación.
Melzack y Wall publicaron en 1965 su nueva teoría del dolor con la hipótesis de la compuerta. Luego Wall y Sweet revisan la estimulación de nervios periféricos en el manejo del dolor. En 1967 Shearly implanta el primer estimulador espinal para manejo de dolor . A partir de este momento comienzan a aplicarse estos implantes indiscriminadamente en todo tipo de dolor durante 12 a 15 años; 70% fueron aplicados en pacientes con lumbalgia de todo tipo y se encontró poca efectividad.
La revisión de las grandes casuísticas no permitió encontrar por qué en algunos pacientes funcionó y en la mayoría no; para ese momento no se conocía bien el concepto de dolor neuropático , las indicaciones quirúrgicas se dirigían más hacia el síndrome de espalda fallida; problema muy frecuente en Norteamérica. Mientras tanto en Europa las indicaciones quirúrgicas se dirigían más hacia el dolor por enfermedad vascular periférica y dolor por desconexión.
Se desarrollaron dos tipos de electrodos planos, que se colocaban por laminectomía y percutáneos que se colocaban con la aguja de Touhy; en ambos la idea es lograr el área de parestesias producida por el marcapaso sobre el área del dolor. El advenimiento de las técnicas percutáneas permitió que otros especialistas, diferentes a los neurocirujanos, pudieran utilizar la técnica y dentro de ellos los anestesiólogos. Además permitió que su colocación se realizara sin necesidad de anestesia general. Como desventaja puede ocurrir el desplazamiento del electrodo de su sitio inicial; además la pérdida de corriente por toda la circunferencia del electrodo comparada con los electrodos planos.
Posteriormente la complejidad de los electrodos fue aumentado de 4 a 8 y luego hasta 16 o más. La utilización de 4 electrodos permite hasta 50 combinaciones (amplitud, ancho de pulso y frecuencia) en comparación con 8 electrodos que permiten 6.050 combinaciones mientras que 16 electrodos permiten 40 millones de combinaciones. Para la mayoría de los pacientes, los 4 electrodos son suficientes
La tecnología ha permitido que los marcapasos sean alimentados con baterías intracorpóreas o que sean alimentados por radiofrecuencia de manera que se acoplan por un transmisor externo. Esta última modificación ahorra la necesidad de intervención para recambio de la batería.
Hoy en día existe la posibilidad de que el paciente posea un programador, que le permita prender o apagar el equipo así como modificar algunos de los parámetros que permitan un ahorro de la batería.
En los últimos años se ha encontrado que las mejores indicaciones de la estimulación espinal son: dolor crónico por desconección preferiblemente el que se acompaña de alteraciones autonómicas así como dolor por isquemia cardíaca o periférica. No tiene utilidad en dolor nociceptivo por ejemplo por artritis, post operatorio, por cáncer, no tiene utilidad en avulsión del plexo braquial, pero si en lesiones parciales del mismo, en sección medular no siempre mejora el dolor en banda de la paraplejia pero puede servir en el dolor del miembro fantasma, se han encontrado utilidad en el síndrome de raíz batida.
Nashold y Friedman reconocieron en 1972 que aquellos dolores con sensación de ardor y con daño neurológico sensorial así como en causalgia tenían buena respuesta a la estimulación.
Los criterios de selección de estos pacientes incluyen:
Existe valor predictivo entre las pruebas psicológicas (Oswetry Disability Index, McGill Pain cuestionario (short form), cuestionario Roland Morris, Inventario de Depresión de Beck.
Se define como dolor crónico asociado a enfermedad degenerativa de columna, generalmente en la región lumbosacra, con historia de múltiples operaciones previas, en ausencia de criterios de descompresión o estabilización.
Se han encontrado factores predictivos de buena respuesta a esta patología en: tratamiento temprano de 0-3 años después de la primera cirugía fallida; predominio del dolor neuropático en la pierna; ausencia de patología psicológica como depresión.
En estudios se ha encontrado que los pacientes con espalda fallida a los que se le colocó marcapaso, 47% mejoró más de 50% en alivio del dolor comparado con la reintervención en la cual sólo el 12% logró este grado de alivio; de igual manera los pacientes con estimuladores espinales requirieron mucho menos opioides que los reintervenidos
Se divide en tipo I y II. Tipo I conocida como distrofia simpática refleja donde no existe lesión conocida del nervio, y tipo II, llamada causalgia ,la lesión del nervio es conocida.
En el tipo 1 la meta del tratamiento es recobrar el uso del miembro afectado lo antes posible; el marcapaso debe indicarse precozmente, si ha fallado la terapéutica medica, preferiblemente en un período de 12-16 semanas.
Se ha reportado que existe mejoría del edema asociado a esta condición con la estimulación espinal.
Se han reportado complicaciones en 19.5% de 103 pacientes, en un período de 7 años. En un análisis retrospectivo de 22 años de experiencia en 410 pacientes encontraron las siguientes estadísticas:
Se han reportado complicaciones más serias como el hematoma epidural con paraparesia, que ha requerido reintervención de emergencia, con buena recuperación.
Se pueden observar cambios en relación a la estimulación del marcapaso con el tiempo y estos se han relacionado a la fibrosis que se forma alrededor del electrodo y que aumenta la resistencia al paso de la corriente.
Los pacientes sometidos a anticoagulación tienen más riesgo a formar hematomas, con riesgo de parálisis de los miembros por compresión de vías nerviosas.
Entre las complicaciones del uso del marcapaso pueden aparecer molestias a nivel de la pared torácica por estimulación de raíces nerviosas, asi como dolor en área de colocación del marcapaso.
En pacientes con dolor neuropatico crónico intratable, la estimulacion espinal con marcapaso disminuye la intensidad del dolor y mejora la calidad de vida.
Demostrar la utilidad del marcapaso espinal, en sus 2 modalidades de implante de electrodos, en el tratamiento del dolor neuropático crónico.
Se realizó un estudio retrospectivo y revisión de 16 pacientes implantados con marcapasos espinales por dolor crónico intratable, Se utilizo el sistema Itrel® de Metronics con la implantación de electrodos percutáneos y planos, de 4 canales,
Previo a la colocación de los marcapasos los pacientes fueron sometidos a pruebas de laboratorio pre operatorias de rutina.
Se utilizaron electrodos tetra polares percutáneos PISCES-Quad Model 3487®, Electrodo plano para laminectomía RESUME II modelo 3587A®, estimulador ITREL 3 modelo 7425®, Controlador manual para pacientes 7434® que permite al paciente encender y apagar el estímulo eléctrico así como el manejo de la amplitud, ancho de pulso y frecuencia
Los electrodos fueron colocados en regiones dorsales y lumbares de acuerdo a la sintomatología del paciente, ésto bajo anestesia local con control fluoroscópico, realizando la prueba de estimulación intra operatoria, previo a la colocación definitiva de la batería, siempre y cuando el área estimulada coincidiera con el área de dolor.
Se realizó tratamiento preventivo con antibióticoterapia profiláctica con cefazolina sódica. Estos pàcientes egresan a las 24 horas, con controles sucesivos donde se evalúan con la escala visual analógica y la cantidad de analgésicos requeridos, grado de incapacidad, efectos adversos y fallas de equipo.
Cuando la respuesta a la prueba de estimulación es positiva con una adecuada cobertura de las parestesias sobre el área de dolor, se procede al implante del generador. Se controla la intensidad de la corriente, la frecuencia y el ancho de pulso.
Durante la cirugía existen una serie de precauciones que deben tomarse en cuenta para evitar daños al equipo como son:
No doblar ni torcer el electrodo y si fuese demasiado largo se debe enrollar con bucles no menores de 2cm de diámetro; la manipulación del electrodo debe realizarse con las manos o con pinzas protegidas con caucho en las puntas. Siempre se debe evitar colocar puntos de sutura directamente sobre el electrodo por riesgo de fractura del mismo. Durante la colocación del electrodo en el espacio epidural se debe evitar pasarlo con fuerza pues podríamos lesionar la dura o la médula, el manejo de instrumentos con filo, cerca del electrodo, debe realizarse con cuidado.
Colocación de electrodo percutáneo:
La primera etapa corresponde a la colocación del electrodo, el paciente debe estar despierto pues sus comentarios del area de la parestesia son importantes. El paciente debe estar en posición prona, se pueden utilizar almohadas para que esté cómodo, se utilizan antibióticos profilácticos endovenosos para evitar infecciones, se debe realizar la asepsia de toda la espalda del paciente y luego se colocan los campos quirúrgicos de manera habitual.
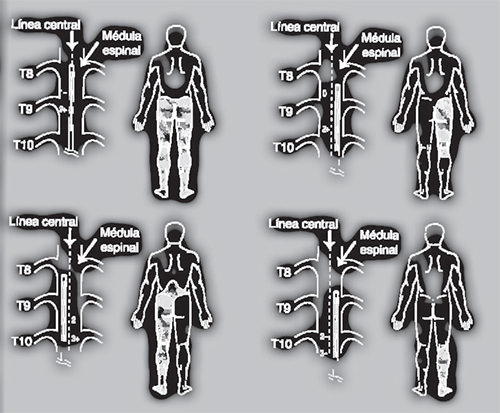
El siguiente paso es, utilizando el fluoroscopio, identificar los niveles de las vertebral y marcarlos sobre la piel. Esto permitirá definir el nivel de entrada de la aguja de Touhy y la altura a la que se dejará el electrodo que pasa por ella con el siguiente esquema de guía: Tabla 4

Existen dos tipos de electrodos los percutáneos cilíndricos, tetrapolares que se introducen con la aguja de Touhy y los planos que se colocan bajo laminectomía. Para colocar el electrodo con la técnica percutánea se deben seguir los siguientes pasos:
Para evitar estimulaciones desagradables debe:
Una vez encontrada la combinación de electrodos, hemos aprendido que es preferible dejar que sean los dos electrodos del medio 1y 2 (La numeración es 0, 1, 2,3 de distal a proximal) los que coincidan con la mejor estimulación, de tal manera que si existiera algún desplazamiento del electrodo todavía podríamos mantener una adecuada estimulación con los electrodos de la periferia, teniendo mucho cuidado de no cortar el electrodo al tratar de retirarlo con la aguja. Ver figura 1.
Después de encontrar la adecuada ubicación del electrodo, la aguja de Touhy se debe retirar con cuidado, retirar la guía metálica central y se debe fijar el electrodo, para evitar su desplazamiento. La mejor opción es la de utilizar el ligamento supra espinoso como punto de anclaje, para lo cual hay que tener la incisión de unos 5-7 cm y que permitan exponer el ligamento, donde el uso de separadores automáticos es recomendado para una adecuada visualización. Para lograr una adecuada fijación debe utilizarse la pieza de anclaje que tiene un orificio para el pase del electrodo y otros 3 para los puntos de sutura.
En la etapa siguiente se procederá a preparar el bolsillo para la colocación del marcapaso, previa comprobación con el programador de su adecuado funcionamiento.
La selección de la ubicación del bolsillo depende de la ubicación del electrodo y las tres más frecuentes son 1.- pared anterior del abdomen 3-4 cm por debajo de la última costilla y que no coincida con la línea del cinturón, 2.- pared postero lateral por encima de la región glútea y 3.- en el área subclavicular; se debe realizar una incisión de 3 cm. de longitud que permita la colocación del marcapaso, el cual no debe quedar más profundo de 1 cm de la piel y paralela a esta.
Para hacer llegar el electrodo, se hace uso del tunelizador, a través del cual se pasa la extensión eléctrica que conecta el electrodo con el marcapaso.
Las uniones de los electrodos deben protegerse con los dispositivos de silicón que evitan el contacto de los fluidos corporales con la corriente. Luego se procede al cierre de manera convencional
Dentro de las consideraciones posoperatoria se recomienda:
Al igual que el electrodo percutáneo, se coloca al paciente en posición decúbito prono, se realiza la antisepsia y se colocan los campos quirúrgicos. Con la ayuda del intensificador de imagen se ubican las vertebras involucradas en la cirugía y se marcan desde T8 aL1. Se recomienda realizar la incisión de piel un nivel por encima y uno por debajo del nivel donde va colocado el electrodo. Se infiltra con lidocaína al 2% el área donde se realizará la laminectomía. Una vez realizada la incisión se procede a la exposición utilizando el electrocauterio hasta exponer las láminas involucradas, se coloca el separador de laminectomía auto estático.
Con la ayuda del Rongeur se remueve la porción caudal de la apófisis espinosa de la vértebra superior al punto de entrada del electrodo, para exponer el espacio interlaminar y el ligamento amarillo. Se elimina el ligamento amarillo con la pinza de Kerrison hasta el ancho del electrodo. La grasa peridural se coagula con bipolar y se expone la duramadre. Se pasa el instrumento separador que viene en el kit, del ancho del electrodo definitivo, y se diseca el espacio peridural hasta la altura donde va ha ser colocado el electrodo, Se debe tomar en cuenta el ángulo de entrada del disector que debe ser lo más plano posible para evitar traumatizar la médula espinal. Se puede utilizar el simulador del electrodo para ver si este pasa con facilidad. Una vez colocado en su posición el resto del procedimiento es similar al del electrodo percutáneo previamente descrito.
Se operaron 16 pacientes con rango de edades 6 a 82 años y un promedio de 56,7 y DS +/- de 18,5 años, 9 masculinos (52%) y 7 femeninos (43,8%). (p=0,24)
Los diagnósticos fueron: espalda fallida 9 casos (56%); neuralgia post herpética 3 casos (20%); dolor de muñón post amputación 1 (6%); dolor radicular post resección de neurinoma gigante intra-abdominal de L1 en enfermedad de Von Recklinghaunsen 1 (6%); síndrome regional complejo 1 (6%), sección medular 1 (6%).
De los 16 pacientes 12 tenían cirugías previas, entre 1 a 15 con un promedio de 2 cirugías previas
La duración de la clínica dolorosa, previo al marcapaso fue de 1 a 5 años con un promedio de 2,56 años con una DS ±1,15 años
Solamente 2 pacientes no estuvieron en tratamiento con opiodes previo al marcapaso
De acuerdo a la ubicación del dolor, la mayoría fue en miembros inferiores 11 casos (69%), seguido del dolor torácico 4 casos (25%) y 1 caso de miembro superior (6%)
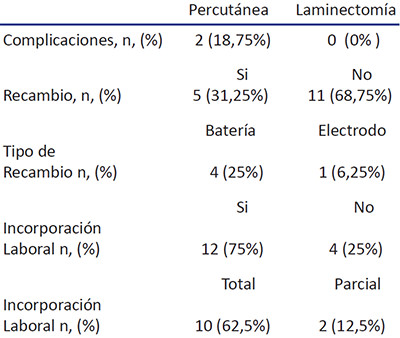
Se realizaron 5 procedimientos percutáneos (31%) y posteriormente por ser la mayoría de los dolores bilaterales se realizaron 11 procedimientos de laminectomía (69%). Tabla 5

A los 2 primeros pacientes se realizó colocación de electrodos por vía percutánea y fueron los que presentaron la complicación de migración del electrodo, en ambos a las 2 semanas, situación que fue superada en los próximos pacientes, colocando la estimulación deseada de la médula con los contactos mediales del electrodos y no los distales, pues si estos se movilizan un poco, se logra la estimulación con los contactos distales, esta complicación se presentó en el 18,75% de los pacientes, la segunda complicación fue por traumatismo sobre el marcapaso que produjo un hematoma que se infectó secundariamente y requirió el retiro del equipo, con recolocación en el lado contrario. Se hicieron 4 recambios de baterías por agotamiento; de estos recambios, en dos pacientes se recambió en una oportunidad, uno en dos oportunidades, y una en cuatro oportunidades, siendo el promedio de duración de las baterías de 3,4 años antes de su agotamiento.
Para poder evaluar la efectividad de procedimiento se tomaron en cuenta tres parámetros:
Los pacientes sometidos a este procedimiento, presentaron valores de Escala Visual Analógica (EVA) entre 7 y 10 puntos, con un promedio de 8,56 puntos, y DS+/- 0,89; la evaluación con la misma escala a los 3 meses mostró una reducción del dolor que se mantenía en el rango de 2-6 puntos con un valor promedio de 3,31 puntos y DS +/- 1,13. lo que representa una caída de 5,25 puntos de promedio en los primeros 3 meses. Gráfico 1.
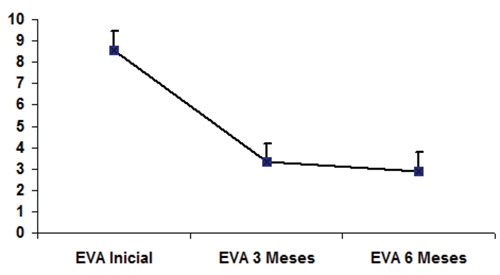
La medición a los 6 meses mostró un rango de EVA de 1 a 6 puntos con un promedio de 2,87 puntos y DS+/-1,25 puntos. Cuando se compara el valor promedio de caída a los 3 – 6 meses se encuentra disminución de 0,43 puntos.
La aplicación del HSD Test así como el Mann-Whitney U test, muestran una p de 0,0001 significativa en la reducción de la escala EVA inicial comparada con los resultados a los 3 meses de la cirugía.
Mientras que el Mann-Whitney test aplicado a los cambios entre la medición de los 3 y 6 meses da una p = 0,238 no significativa.
El número de complicaciones entre las dos técnicas no muestra diferencias significativas entre ellas (p=0,14)
Se compararon los pacientes con diagnóstico de espalda fallida, con los portadores de las otras patologías en relación a incorporación al trabajo se encontró una p= 0,77 aplicando Pearson Chi cuadrado donde no hay diferencia significativa entre los resultados de estos 2 grupos. Tabla 7

Cuando se utiliza el parámetro de reducción de analgésicos en pacientes con espalda fallida y estos se comparan con las otras patologías tampoco hubo diferencias significativas con Pearson Chi-cuadrado (p=0,3) Así mismo las complicaciones entre los dos grupos no mostraron diferencias. Tabla 8
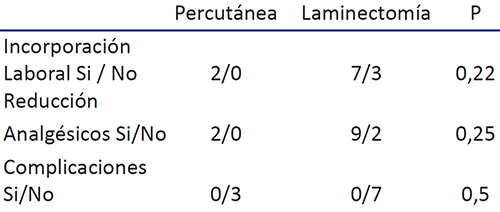
Se buscaron diferencias en los resultados con las dos técnicas quirúrgicas comparando reducción de analgésicos e incorporación al trabajo dando p=0,3 y 0,1 respectivamente ( no significativas).
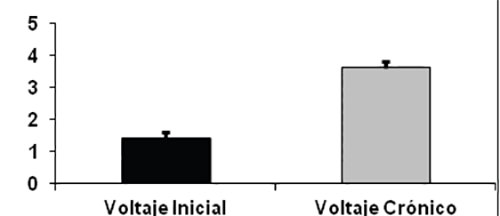
El voltaje inicial de estimulación fue en promedio de 1,41 V con un rango entre 1,2 y 1,8 Voltios y DS +/-0,21 Volt. Esta estimulación hubo que incrementarla progresivamente para llegar a tener un promedio de 3,61Volt con un rango entre 2,8 y 4,2Volt. Con DS +/-0,45. Esto muestra un aumento de 2,2 voltios con DS +/- 0,48V entre el inicio y los 6 meses. Gráfico 2.
De los 4 pacientes en los que no hubo incorporación al trabajo, 1 era policía de profesión y después se demostró que existían problemas laborales y uso excesivo de opiáceos. El segundo y tercer caso corresponden a problemas laborales de litigio con ganancia secundaria y el cuarto caso correspondía a dolor en banda en una sección medular con lesión de cordones posteriores donde no hubo buena respuesta al control del dolor.
El presente estudio es la revisión de la experiencia en el Hospital Universitario de Caracas y en la práctica privada, de pacientes con dolor crónico intratable que fueron sometidos a la estimulación eléctrica medular con marcapasos. Si bien el número de pacientes no es muy elevado, son los acumulados en un período de 12 años, y puede considerarse que es un número importante en nuestro medio, ya que no existen reportes previos en nuestro país con esta casuística, debido a los altos costos de los equipos que hacen que sean de difícil acceso a los pacientes.
La selección de pacientes es la clave del éxito de esta técnica, la evaluación psicologíca previa es importante para excluir pacientes con trastornos psiquiátricos que no mejoran con la estimulación medular.
El rango de edad de nuestros pacientes es similar a los estudios previos, aun cuando se sabe que la edad no es un factor que modifique la respuesta a la estimulación. En nuestro estudio se encontró un predominio de sexo masculino, no significativo, no se encontró bibliografía previa que hable del sexo como factor predictivo de respuesta a la estimulación espinal.
El diagnóstico más frecuente fue el de espalda fallida, que es la indicación más aceptada en los Estados Unidos de Norteamérica.
Existen evidencias que demuestran el uso de los estimuladores en diferentes patologías como el síndrome regional complejo, dolor por desconexión, dolor neuropático, etc., con buenos resultados.
Los estimuladores espinales funcionan cuando están preservadas las columnas posteriores y es posible estimularlas.
Cincuenta a 60% de los pacientes con diagnóstico de espalda fallida obtienen alivio de su dolor; en cambio para dolor neuropático, síndrome regional complejo, los resultados son superiores.
Los resultados demuestran una tendencia a la mejoría de los pacientes de acuerdo a los parámetros evaluados: escala visual analógica, incorporación al trabajo y reducción de analgésicos. Se encontró una respuesta estadísticamente significativa.
En nuestro grupo 100% de los pacientes tiene indicación del uso de marcapaso apoyado por la evidencia estadística en la bibliografía y de allí que los resultados de esta técnica fueron favorables.
Existen reportes de los beneficios de esta técnica en la literatura, basados en la incorporación al trabajo; estos reportan entre un 40-60%; en la presente muestra 75% de los pacientes logró algún grado de incorporación; se encontró que de ellos 62,5% se incorporó de manera total al trabajo, mientras que 18,75% lo logró de manera parcial, quedando un 18,75% que no pudo incorporarse a sus actividades laborales.
En relación al uso de analgésicos, hubo en el 87,5% de los pacientes reducción del uso de analgésicos superior al 50%.
Este tipo de tratamiento no tiene efectos secundarios, pero presenta complicaciones. Se encontraron en el 18,75% de los pacientes; 12,5% presentaron migración del electrodo y en un caso (6,25%) hubo infección secundaria a un traumatismo sobre el marcapaso al año de su implante, que produjo un hematoma infectado, que requirió el retiro del marcapaso, la pérdida del mismo y necesidad de recolocación de nuevo marcapaso en otra ubicación.
En relación a las migraciones, estas se presentaron en los electrodos percutáneos, en los dos primeros pacientes, que requirieron recolocación en quirófano a las 2 semanas de su colocación, y fue corregido en los casos posteriores con la estimulación adecuada con los electrodos mediales, así que si sucediera una migración se podría compensar con los electrodos de los extremos. Esta complicación ha sido reportada en otras publicaciones siendo las más frecuentes a nivel cervical y dorsal (80% vs. 4.4% respectivamente)
Los resultados obtenidos son similares a estudios reportados por otros autores, encontrando reducción significativa en la escala visual análoga del dolor: Nuestras complicaciones están dentro de lo esperado para otros estudios, La estimulación es una herramienta adecuada cuando se seleccionan bien los pacientes.
Existe un trabajo publicado donde el uso del marcapaso es mejor que la reintervención en el síndrome de espalda fallida con dolor radicular.
Se ha descrito disminución de la efectividad de estimulador en el tiempo con mayor voltaje como lo encontramos en nuestro estudio
En un estudio sistemático de la literatura en relación a complicaciones, se encontró que estas ocurrían entre 20-75% de los pacientes con un promedio de 42% y la mayoría eran menores.
No se retiraron marcapasos.