Los tumores neuroendocrinos (TNEGI) del aparato gastrointestinal representan menos del 5% de las neoplasias del tracto gastrointestinal, siendo el intestino delgado, en especial el íleon, donde se presentan con mayor frecuencia (30%). Se originan del sistema endocrino difuso gastrointestinal y tienen capacidad de secretar péptidos y aminas bioactivas, principalmente la 5-hidroxitriptamina (5-HT) o serotonina. La Organización Mundial de la Salud (OMS) los clasifica de acuerdo al grado de diferenciación y conducta biológica en 5 grados. Las manifestaciones clínicas pueden estar ausentes o ser inespecíficas, su hallazgo, como es el caso de nuestro paciente, puede ser casual. Se reporta el caso de Paciente masculino, CRG, de 63 años de edad, el cual consultó y se evidencia en estudio tomográfico un tumor en mesenterio, cuyo origen era desconocido. Por ser asintomático se decidió observar y evaluar diámetros. En febrero de 2021 con motivo de obstrucción parcial intestinal, se decidió estudiar con TAC con doble contraste, endoscopia superior e inferior sin evidencia intraluminal que explique una compresión mecánica. Fue intervenido quirúrgicamente, (marzo 2021), practicándose Resección de tumor del mesenterio que infiltra el asa ileal más resección de metástasis hepáticas, Segmento II, VI y VIII, con reconstrucción Íleo-transversa. Biopsia más inmunohistoquímica reportó Tumor Neuroendocrino bien diferenciado (TNEG1) con menos de 2 mitosis por 10CAA y Ki67 del 2% (WHO/2017 Grado 1). El tratamiento de los tumores (TNE) varían desde la resección quirúrgica en los estadios menos avanzados hasta tratamiento quirúrgico asociado a quimioterapia y radioterapia en los más avanzados con una tasa de supervivencia a los 5 años y 10 años de 73 y 65% para tumores bien diferenciados. De allí la importancia del diagnóstico precoz. Así mism-o re-saltar la canulacion de la válvula íleo-cecal durante la colonoscopia de pesquisa. RCM 2023. 62;155(1): 18-24.
Palabras clave: Tumor neuroendocrino, Ileoscopia, Inmunohistoquímica, tratamiento.
The gastrointestinal neuroendocrine tumor (NET), also called Gastrointestinal Carcinoid tumor, represente less tan 5% of gastrointestinal tract neoplasms, being the small bowel, specialiiy ileon, the most frecuent location (30%), the originate from diffuse endocrine gastrointestinal system and are able to secrete peptides and bioactive amines, mainly 5-hidroxytriptamine (5-ht) or serotonine. The World Health Organization (WHO) classifies them according to its differentiation grade and biological behavior en 5 grades. The clinical manifestation coulb be absent or non especifics. Its finding as in our patient case can be casual. We report a case of a 63 years old masculine patient who complaimed of mesentery tumor of none origen know. Asintomatic until febrery 2021 with clinical of intestinal parcial obstrucción. TAC with doble contrast, endoscopic upper oad lowe, no luminal extra or intra of mecanic compresión. Laparotomy with mesenteric tumor in contac with intestinal ileon and metastatic lession en seg II, VI, VII hepatic. The biopsy and inmunihistochemestry report Well differetiated neuroendocrine tumor. The treatement of NET varies fron surgical resection alone in the less advanced stages, to surgical treatment associated to chemoterapy in the most advanced stages with a survival rate of 73 and 65% in the 5 and 10 years for the well differentiated tumor, being very important its early diagnosis. Equally must be highligted the canulation of ileo-cecal valve during a screening colonoscopy. RCM 2023. 62;155(1): 18-24.
Key words: Neuroendocrine tumor, Ileocopy, Inmunohistochemestry, treatment.
Los TNE del aparato gastrointestinal son tumores raros, derivados de las células neuroendocrinas. Su frecuencia ronda los 8,4/100.000 (2) habitantes, representando menos del 5% de todas las neoplasias gastrointestinales y el 0,49% de todos los tumores en general . Aparecen con mayor frecuencia en el aparato gastrointestinal (74%), siendo el intestino delgado, en especial el íleon, donde se presentan con mayor frecuencia (30%) pero también ocurre en el sistema broncopulmonar (25%). El 1% restante, ocurre en la laringe, la vesícula biliar y los conductos biliares extrahepáticos, el hígado, el bazo, los ovarios, los testículos, el cérvix y las mamas.
Derivan de las células neuroendocrinas del aparato gastrointestinal, por lo que tienen capacidad neurosecretora. Sintetizan gran cantidad de aminas bioactivas como 5-hidroxitriptamina o serotonina (5- HT), péptidos como la cromogranina A, taquicininas y varios factores de crecimiento entre ellos el factor de crecimiento transformante beta (TGF-B).
La mayoría de estas neoplasias son bien diferenciadas y su diagnóstico se establece con relativa facilidad, mediante microscopía de luz e inmunohistoquímica.
Los tumores neuroendocrinos se denominan de acuerdo a la hormona que liberan. Solo si esta se produce en cantidades medibles y es funcionalmente activa, de lo contrario, solo se denominan ¨neuroendocrinos¨. Asimismo, pueden presentarse de forma esporádica o asociados a síndromes familiares como el síndrome de Von Hippel Lindau y la neurofibromatosis.
El diagnóstico precoz, permite ofrecer un tratamiento oportuno y simple, así como, predecir su curso clínico.
El tumor carcinoide de células enterocromafines es el tipo histológico más común. Esta estirpe tumoral se caracteriza por poseer propiedades argentafinas a la tinción, a la producción de serotonina y gránulos secretorios pleomorfos. Son de tamaño medio, muestran leve o moderada atipia, la tasa de crecimiento es lenta (menor de 2 mitosis x 10 campos de alto poder y no presentan necrosis tumorales. Se establecieron diferentes patrones de crecimiento tumoral: el nodular o insular, el trabecular, el acinar, el tubular y el atípico.
En los pacientes con TNEG localizado en el duodeno, yeyuno, se encuentran en orden descendente de frecuencia: los gastrinomas, las somatostatinomas y los paragangliomas gangliociticos.
La clasificación de los TNEG ha variado a través de los años. Recientemente, nuevas clasificaciones dan énfasis en el grado de diferenciación del fenotipo neoplásico basándose en el potencial maligno. La conducta biológica puede cambiar con la localización tumoral, su tamaño o el índice de proliferación (Ki-67).
Estas características sumadas a otras asociaciones como: los datos de invasión vascular, los cambios biomoleculares, la presencia de receptores de somatostatina y detección de marcadores neuroendocrinos como: la cromogranina (en tejidos y sangre periférica), son variantes imprescindibles en la categorización de los tumores neuroendocrinos.
La clasificación de la Organización Mundial de la Salud, recientemente actualizada por la Sociedad Europea de Tumores Neuroendocrinos, es un sistema TNM con estratificación por grados, según la tasa mitótica y el índice de Ki-67, es la masa aceptada en la actualidad. Aunque todos los TNEG presentan potencial maligno. Las guías simplifican el pronóstico del paciente según la localización del tumor, su tamaño, invasión y el compromiso con los ganglios linfáticos, así como la presencia de metástasis.
El sistema de estratificación en grados, nació del estudio de tumores del llamado intestino anterior (los bronquios, el estómago, el duodeno, el páncreas y las vías biliares) y posteriormente con el análisis de los TNEG bien diferenciados del intestino medio y posterior (desde el ligamento de Treitz hasta el recto, incluyendo el apéndice).
Se toma en cuenta el índice mitótico y el índice Ki-67, de la siguiente forma: G1 (> 2 mitosis/ 10 campos de alto poder (HPF) y/o índice Ki-67<2%), G2 (2-20 mitosis/ HPF y/o Ki-67 entre 3-20%) y G3 (>20 mitosis/HPF y Ki- 67>20%). El G1 y G2, son tumores bien diferenciados que expresan cromogranina A y sinaptofisina. Los G3, sin tumores mal diferenciados, con necrosis, bajo niveles de cromogranina A y tinción intensa con sinaptofisina. Estos conllevan a un peor diagnóstico (Cuadro 1).

Los subtipos de TNEG, se dividen según su localización anatómica:
En el íleon, se originan más comúnmente los tumores carcinoides, y a su vez, son las neoplasias más frecuentes del intestino delgado. Un 17% del total de TNEG, se encuentran en el íleon. La mayoría de estos se localizan a 60 cm de la válvula ileocecal. Estos se derivan de la transformación maligna de células enterocromafines, por lo que se espera un aumento en la producción de serotonina. Además, hay aumento en los niveles de taquiquininas, neurokininas A, neuropéptido P y sustancia P. El intervalo de edad del diagnóstico es de 55 a 63 años de edad y generalmente se presentan con dolor abdominal y datos de obstrucción intestinal. Menos común son la diarrea, el sangrado gastrointestinal y la pérdida de peso. La invasión transmural y la fibrosis se observan en forma común y reflejan agresividad del tumor.
La mayoría de los pacientes se mantienen asintomáticos hasta que la neoplasia se encuentre en fase avanzada. Los síntomas se presentan por efecto compresivo local, fibrosis o secreción de productos vasoactivos. Estos son inactivados por el hígado, sin embargo, cuando hay metástasis hepáticas los agentes bioactivos, se secretan en sangre, sin sufrir metabolismo hepático, lo cual produce una serie de síntomas conocidos como síndrome carcinoide.
La mayoría de los síntomas obedece a la localización del tumor y el tipo de sustancia secretada por la neoplasia. Síntomas comunes de los TNEG son: el dolor abdominal, la pérdida de peso y los cambios en el patrón intestinal.
El síndrome carcinoide se desarrolla de un 10% a un 15% en los pacientes diagnosticados con TNEG. Los síntomas característicos son: la diarrea, enrojecimiento facial y falla cardiaca, conocida como la ¨tríada clásica ̈ del síndrome carcinoide. Otros síntomas son broncoespasmos y pelagra (deficiencia de niacina o vitamina B3).
El diagnóstico de los TNEG, debe realizarse usando marcadores bioquímicos seguidos de estudios de imágenes, con el fin de localizar el tumor primario y focos de metástasis. Otras características particulares de los TNEG y para lo cuál se debe tomar especial consideración, son las relacionadas al comportamiento multicéntrico, la asociación con otras neoplasias, síndromes y la aparición del síndrome carcinoide con su tríada característica. Los marcadores bioquímicos pueden dividirse en específicos y no específicos. El marcador específico por excelencia es la mediciòn urinaria de ácido 5-hidroxindol-3 acético (5- HIAA). Presentan una especificidad del 88%.
De los marcadores no específicos tenemos a la cromogranina A (CgA), la enolasa neuroespecífica (NSE) y la hormona gonadotrofina coriónica (HGC). Estas se presentan como glicoproteínas almacenadas en gránulos secretorios de células neuroendocrinas. Hay una correlación significativa entre los niveles séricos de CgA y el cr ecimiento tumoral.
La NSE, es el isómero neuro específico de la enzima glicolítica 2-fosfo-D-glicerato hidroxilasa o enolasa. Estas se encuentran presente en células neuroendocrinas. Los niveles séricos de NSE se elevan en diferentes tipos de tumores neuroendocrinos y se asocian con tumor pobremente diferenciado.
La localización del tumor se realiza por estudio de imágenes, entre ellos la gastroscopia, el ultrasonido endoscópico, las radiografías con doble contraste de bario, ultrasonografía, TAC, RMN, angiografía, radioscan utilizando receptores de somatostatina (SRS), PET (Tomografía por emisión de positrones), radioscan con metayodobencilguanidina (MIBG) y cápsula endoscópica.
El único tratamiento curativo es la cirugía. El manejo quirúrgico difiere según su localización, tamaño y subtipo del tumor.
Las neoplasias neuroendocrinas del intestino delgado, tienen alto potencial maligno, independiente de su tamaño, por lo tanto, se debe realizar resección quirúrgica y extirpación de ganglios linfáticos adyacentes en todos los casos.
En caso de tumor resecable y metástasis hepáticas, estás últimas pueden ser extirpadas con beneficios para el paciente, incluso de forma curativa.
Además del manejo quirúrgico, existe tratamiento no quirúrgico, para pacientes en estadios irresecables del tumor o no- candidatos a cirugía: Quimioembolización arterial transcateter (TACE), quimioterapia, análogos de somatostatina, interferón-alfa y agentes biológicos. La TACE, es un método importante a la hora de abordar pacientes con enfermedad avanzada.
Los quimioembolizadores con dexorrubicina y estreptozotocina, o ambos, han producido mejoría sintomática y disminución de los niveles de 5-HIAA urinario. La quimioterapia en general ha sido poco satisfactoria en el manejo de los TNEG.
Los análogos de somatostatina (octreótido y lancreotido), controlan los síntomas, especialmente asociados al síndrome carcinoide, entre un 60% y 80% de los pacientes. El interferón -alfa, se ha utilizado en el tratamiento de los TNEG, ya que disminuye la sintomatología del paciente y presenta, al igual que los análogos de somatostatina, efecto tumoricida (disminuye el tamaño del tumor).
Los nuevos agentes biológicos entre ellos el Bevacizumab (inhibidor del VEGF o factor de crecimientos endotelial vascular), han sido motivo de nuevos estudios recientes. Especialmente, aquellos relacionados a la disminución del tamaño tumoral y aumento de la sobrevida del paciente con estos regímenes.
Se trata de paciente del sexo masculino, CRG, de 63 años de edad, quien consulto por un hallazgo asintomático en TAC abdomino –pélvica, de lesión sólida de contornos lobulados, moderamente hipervascularizada, situada en la región del mesenterio que midió 38.9 x 31.4 mm. Se demostró un Cúmulo Cálcico Grueso en el interior de la lesión, de unos 15 mm (Imagen 1).
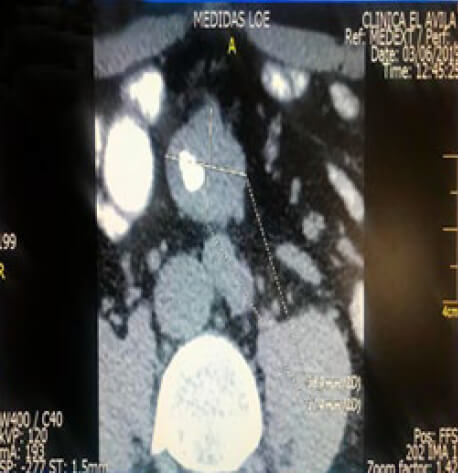
Un año más tarde y por estabilidad radiológica, se practicó nueva TAC abdomino-pélvica, donde se evidenció LOE ubicado en los planos del mesenterio en la línea media que mide aproximadamente 4 cm de diámetro transversal por 3,2 cm anteroposterior. Es sólido y presenta una gruesa calcificación en su interior. Sus contornos son bien definidos, sin embargo; existen algunas imágenes periféricas con tractos lineales hacia el mesenterio.
No hay patrón obstructivo de asas delgadas. El contraste resaltó en forma relativa segmentaria las asas delgadas, por lo cual es difícil precisar una lesión eventualmente primaria a nivel de yeyuno o asas ileales. Sin embargo, existe un asa ileal cercana a la lesión mesentérica con un discreto engrosamiento de la pared que ameritó otros estudios para mejorar su evaluación.
El estudio radiológico concluyó LOE sólido en mesenterio con características descritas sugestivas a la posibilidad de Tumor de Tipo Carcinoide. No se descartó lesión en asa cercana, sin embargo, el hallazgo no fue concluyente. La región ileocecal no muestra alteraciones (Imagen 2).
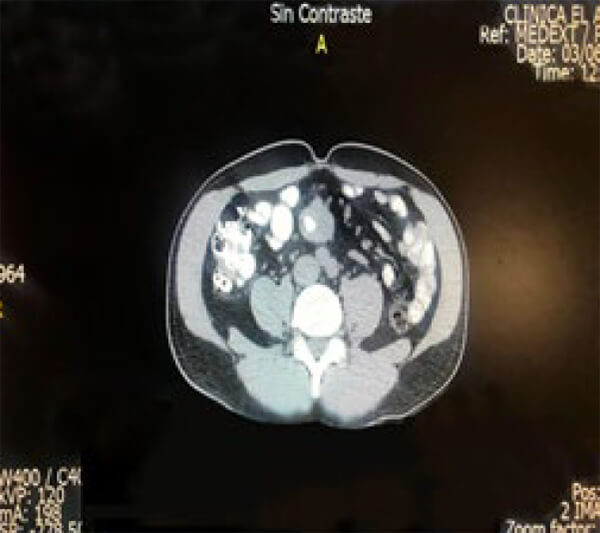
Se practicó endoscopia digestiva superior e inferior más tránsito con doble contraste sin evidencia de lesión obstructiva. Con diagnóstico de Tumor del mesenterio, se practicó Laparotomía exploradora a través de incisión media.
Los hallazgos evidenciaron Tumor en mesenterio de 4 cm de diámetro mayor que infiltra hasta asa ileal retrayendo la misma. Metástasis hepáticas en número de tres (3) ubicadas en segmentos II, VII y VIII (3, 2 y 1,8 cm respectivamente).
Se practicó Hemicolectomía derecha con resección de 30 cm de asa ileal. Resección de metástasis hepáticas, imagen 3. En segmento II, VII, VIII. Anastomosis ileotransversa. Colecistectomía. Resultado inmediato satisfactorio, ver imágenes 3 y 4
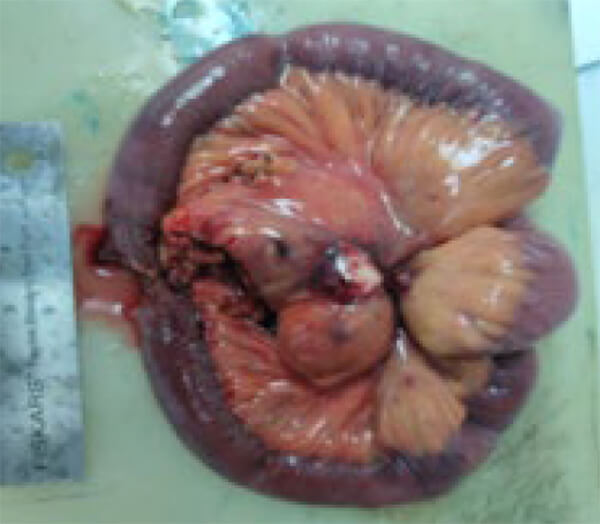
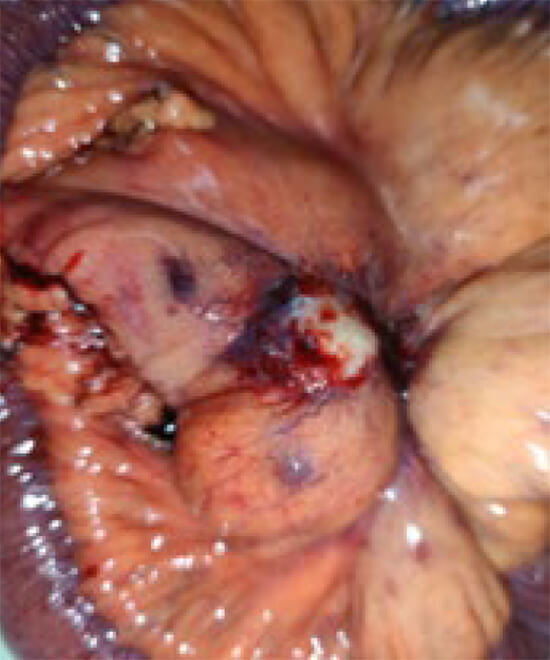
Se recibe biopsia definitiva, practicada en CMC, N° B21-00224, que concluye: Neoplasia endocrina morfológicamente de bajo grado. Localizado en íleon a 22 cm del borde de resección. Mide 2,7 x 2,5 cm, infiltra todo el espesor de la pared y alcanza el tejido adiposo del meso íleon. Presencia de invasión vascular linfática, no se observa invasión perineural.
Se trata de una lesión predominantemente submucosa con un marcado crecimiento en profundidad en la pared del intestino. Se identifican cinco ganglios linfáticos, cuatro con metástasis por neoplasia endocrina. El ganglio de mayor tamaño muestra en el centro una porción calcificada de 1 cm de su dimensión máxima. Los bordes de resección proximal y distal están libres de neoplasia. Nódulos hepáticos del segmento II, (tamaño 3 cm) VII (tamaño 1,6 cm) y VIII (tamaño 1,3 cm), metastásicos por neoplasia endocrina. Morfológicamente de bajo grado. La neoplasia se clasificó como en estadio IV( pt4pN1pM1a) de la AJCC.
Fue referido para evaluación médica-oncológica. Para el momento de la consulta el paciente refirió estar recuperándose satisfactoriamente de la cirugía, si bien se quejó de astenia, anorexia y pérdida de peso, negó dolor, sofocos y episodios severos de diarrea. El estado funcional era de 80 en la escala de Karnofsky/Zubrod/eCOG1). Dadas las características de la enfermedad se solicitó Inmunohistoquímica de la pieza y la realización de exámenes complementarios, así como también determinaciones de GGT, serotonina y cromogranina A en suero. Y de ácido 5-hidroxi-indol-acetico en orina de 24 hrs.
Se recibe resultado de inmunohistoquímica, en laboratorio de Alberto Cirac; (Cirac & Díaz) Citologías, S.C 8-04-2012. N° BX21-0442. Estudio de Inmunohistoquímica: mediante la técnica del Polímero de Dextrano marcado con peroxidasa, conjugado al anticuerpo secundario, se practicó la investigación de los siguientes antígenos: se utilizaron controles positivos adecuados. Cromogranina A Positivo en células neoplásicas. Sinaptofisina Positivo en células neoplásicas. Enolasa Neuronal específica Positivo en células neoplásicas. CD 56 Positivo en células neoplásicas. KI 67 Positivo en células neoplásicas, 2%. Reporta Tumor neuroendocrino Bien diferenciado (NETG1) con menos de 2 mitosis por 10CAA y Ki67 de 2%. (WHO/2017 Grado 1)
Se practicó estudio de TAC de abdomen y pelvis con y sin contraste, 14-10-2021, N° de caso: 01911801, obteniéndo múltiples imágenes axiales. Se administró material de contraste por vía oral y vía endovenosa. Conclusión: El estudio no demuestra en forma categórica lesiones ocupantes de espacio. Quiste cortical en el Riñón derecho.
Se recibe resultado de Laboratorio Inmuno 21. 06- 05-2021. Ácido 5-hiroxy-indol-acetico 5.8mg/24hrs Rango <9.9 Serotonina 391 ng/ml Rango < 230 cromogranina A,S 67 ng/ml <93.
Tras extensa conversación con el Paciente CRG, se recomendó mantener en observación periódica y no indicar, por el momento, tratamiento alguno antineoplásico.
Se practicó estudio para control de: CT Pet, practicado en CDD Las Mercedes Caracas, xx-12-2021. Conclusión: CTPet scan sin contraste: Sin alteraciones patológicas. CTPet scan con contraste: Sin alteraciones patológicas.
Los TNEG son un grupo poco frecuente de neoplasias con alto potencial maligno, por lo cual deben tomarse siempre en cuenta en el estudio de neoplasias gastrointestinales.
El tracto gastrointestinal posee el mayor número de células neuroendocrinas del organismo, estas células producen péptidos y aminas que regulan la motilidad, digestión y ayudan a la vigilancia inmunológica. (3,8) A pesar de la amplia gama de células, solo algunas producen proliferación neoplásica, siendo esta más frecuente a nivel de la submucosa del íleon terminal, (como es el caso de nuestra paciente), apéndice vermiforme y recto.
La mayoría de los TNEG se diagnostican en forma tardía, por lo tanto se debe mejorar en los métodos diagnósticos, estadiaje y tratamientos de los mismos. La medición de 5-HIAA urinaria aunque muy específica tiene poca sensibilidad debido a los múltiples falsos positivos.
No se ha encontrado el método de imágenes ideal para la localización del tumor y posibles focos metastásicos.
El pronóstico de los TNE de intestino delgado es desfavorable en comparación con los gástricos y de recto. Usando la data del National Cancer Institute Surveillance, Epidemiology and End results (SEER), la tasa de supervivencia estimada en 5 y 10 años fue de 73 y 65% para tumores bien diferenciados; 71 y 46% para enfermedad localizada y 54 y 30% para enfermedad a distancia respectivamente.
Con base a lo anteriormente expuesto, se concluye en la importancia del diagnóstico precoz del TNE y la aplicación del tratamiento oportuno para mejorar la sobrevida del paciente. Así mismo se recalca la importancia de realizar ileoscopia de retiro, ya que el sitio más frecuente donde se localizan estos tumores es en el íleon terminal.