* Servicio de Alergología e Inmunología, Centro Médico Docente la Trinidad.
** Clínica El Avila.
***Centro Médico de Caracas, Caracas.
DIRECCIÓN: Dr. Mario Sánchez Borges. Centro Médico Docente La Trinidad. La Trinidad, Caracas. e-mail: [email protected]
Centro Médico Docente La Trinidad
Los antiinflamatorios no esteroideos (AINEs) son compuestos que interfieren la síntesis de las prostaglandinas y la inflamación a través de la inhibición de las enzimas ciclo-oxigenasas del ácido araquidónico (COX). La aspirina y todos los AINEs “clásicos” ejercen efectos inhibitorios sobre las isoenzimas COX-1 y COX-2, pero en los últimos años se han incorporado nuevos AINEs que inhiben preferencialmente a la COX-2, tales como el nimesulide y el meloxicam. Más recientemente fueron introducidos los inhibidores selectivos de COX-2 o coxibs que son más específicos y poseen una mejor tolerancia gastrointestinal.
Ya que la teoría más aceptada para explicar la patogénesis de las reacciones adversas a los AINEs es la teoría de la ciclooxigenasa, según la cual la inhibición de COX-1 desviaría el metabolismo del ácido araquidónico hacia la vía de la lipoxigenasa resultando en hiperproducción de cisteinil leucotrienos(1), la disponibilidad de inhibidores selectivos y específicos ha permitido explorar la tolerancia de los pacientes sensibles a AINEs a estos nuevos fármacos.
En el presente artículo nos referiremos a las reacciones adversas cutáneas a los AINEs más frecuentemente observadas en nuestra práctica, que son la urticaria y el angioedema.
Diversas manifestaciones de hipersen-sibilidad cutánea secundarias a la administración de AINEs han sido descritas en la literatura, tales como erupción maculopapular, erupción fija, eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, vasculitis, eritema nodoso, y dermatitis por contacto y fotocontacto. De ellas, las más frecuentes y mejor estudiadas son la urticaria y el angioedema.
Recientemente propusimos una clasificación de las reacciones alérgicas y pseudoalérgicas a los AINEs basados en el patrón farmacológico (reacción a un solo compuesto, reactores simples, o reacciones a múltiples AINEs, reactores cruzados) y el patrón clínico (síntomas y signos) que presentan los pacientes(2). Esta clasificación, que es útil para la práctica clínica, incluye 4 patrones: 1. Respiratorio: el asma con intolerancia a la aspirina, síndrome de Samter, tríada de aspirina o enfermedad respiratoria exacerbada por aspirina (EREA). 2. Cutáneo: urticaria y angioedema. 3. Sistémico: reacciones anafilácticas y anafilactoides inducidas por aspirina y otros AINEs. 4. Mixto: una combinación de angioedema facial y manifestaciones de la vía aérea superior tales como rinorrea, edema laríngeo, y conjuntivitis.
La urticaria y el angioedema pueden constituir la única manifestación clínica o pueden acompañar a reacciones más generalizadas tales como las sistémicas. Con menor frecuencia se observan cuando pacientes con EREA son expuestos a aspirina u otros AINEs.
Se ha descrito urticaria o angioedema por AINEs en hasta el 0,3 % de la población(3), pero estos se observan con mayor frecuencia en individuos atópicos(4), en pacientes con dolor agudo(5), en adultos jóvenes del sexo femenino(6) y en pacientes con urticaria crónica(7).
La patogénesis de la urticaria y el angioedema por AINEs en pacientes cros-reactivos probablemente sea la misma que la de las reacciones respiratorias, a través de la inhibición de COX-1. Un artículo reciente de Setkowicz y col. demostraron que 18 de 36 pacientes con urticaria crónica idiopática que reaccionaron a aspirina pudieron tolerar rofecoxib y celecoxib; dichos pacientes tenían niveles basales elevados de LTE4 urinario, y la severidad y duración de las reacciones cutáneas correlacionaron con dichos niveles. En 8 de los 18 pacientes los niveles de LTE4 urinario se duplicaron durante la provocación con aspirina. Los autores concluyeron que la urticaria y el angioedema desencadenados por aspirina en pacientes con urticaria crónica idiopática son procesos dependientes de la COX-1(8).
En soporte de esta teoría, la mayoría (aunque no todos) de los pacientes cros-reactivos a AINEs con urticaria y angioedema toleran los inhibidores selectivos de COX-2 (ver debajo)(9). Adicionalmente, el pretratamiento con antagonistas de receptores de leucotrienos fue capaz de bloquear las reacciones cutáneas desencadenadas por ibuprofen(10).
Otra observación, que contradecía la teoría de la ciclooxigenasa, era que inhibidores débiles de COX-1, tales como acetaminofen y pirazolona eran capaces de inducir reacciones cutáneas en una proporción variable pero significativa de sujetos cros-reactivos (11). El mecanismo de dichas reacciones no ha sido suficientemente estudiado, pero nosotros hemos propuesto que éstas podrían estar relacionadas con la inhibición de un novel producto del gen de la COX-1 recientemente descrito como COX-3(12).
En los pacientes que reaccionan a un solo AINE y moléculas químicamente similares las reacciones son de naturaleza alérgica, mediadas por una respuesta de anticuerpos específicos de clase inmunoglobulina E.
El diagnóstico de las reacciones cutáneas a AINEs se sospecha por medio de la historia clínica y se comprueba mediante pruebas de provocación oral controlada(13). Se han propuesto métodos confirmatorios in vitro, tales como la prueba flujocitométrica de activación basofílica (FAST) y la prueba de estimulación alergénica celular (CAST), pero estos no se han popularizado por su costo, el requerimiento de equipos sofisticados, la dificultad de su estandarización y la poca sensibilidad(14).
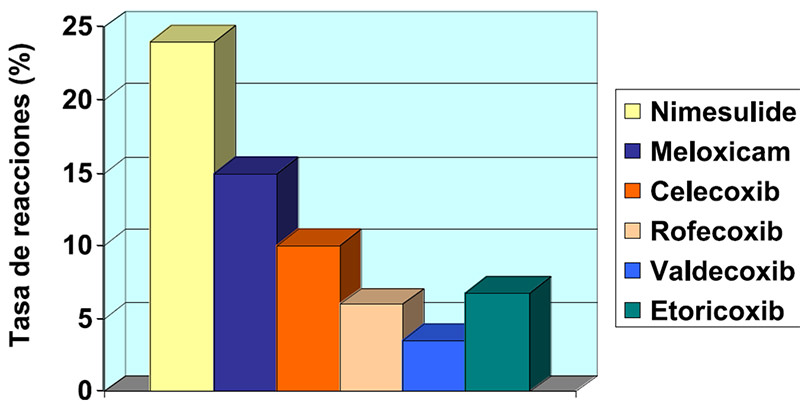
En general, los estudios disponibles en la actualidad permiten afirmar que los inhibidores preferenciales y selectivos de COX-2 son absolutamente seguros en pacientes con EREA(9) y relativamente seguros en pacientes con reacciones cutáneas inducidas por AINEs (15-18) (Figura 1). El potencial de inducir reacciones correlaciona con la potencia inhibitoria de COX-1 in vitro para estas drogas(19), y no pareciera estar relacionado con la presencia de un residuo sulfonamídico(20,21).
Existe en la actualidad discusión acerca de los posibles mecanismos de la urticaria y el angioedema debidos a inhibidores de COX-2 observados en algunos pacientes con hipersensibilidad a AINEs. Por una parte, algunos investigadores postulan que se trata de reacciones alérgicas mediadas por IgE, lo cual sustentan en el hecho de que a concentraciones terapéuticas los coxibs no inhiben a la COX-1 in vivo, y en que los pacientes con EREA y aquellos con urticaria crónica idiopática toleran los inhibidores selectivos de COX-2.
En cambio, nosotros proponemos que las reacciones a coxibs dependen de inhibición de COX-1 por las siguientes razones: 1. Las reacciones se observan en individuos cros-reactivos. 2. Las reacciones pueden ocurrir durante la primera exposición a la droga. 3. Como se mencionó, la tasa de reacciones correlaciona con la inhibición de COX-1 in vitro. 4. Serrano y col. pudieron bloquear reacciones cutáneas a celecoxib mediante el pretratamiento con montelukast, un antagonista de los receptores de leucotrienos de tipo 1 (Cis-LTR1)(22).
Existiría entonces un grupo de pacientes “altamente sensibles” a los AINEs con potencial de reaccionar tanto a los inhibidores débiles de COX-1, como a los inhibidores preferenciales o altamente selectivos de COX-2, tal como han propuesto Matucci y col.(23).
Tradicionalmente el paciente sensible a AINEs clásicos puede ser tratado con drogas alternativas que no inhiben, o inhiben débilmente, a la COX-1. Ellas incluyen: acetaminofen, floctafenina, trisalicilato de colina y magnesio, salicilato de sodio, salicilamida, salsalate, bromuro de hioscina, tartrato de ergotamina, codeína, dextropropoxifeno y otros opioides.
Recientemente se han utilizado con seguridad relativa los inhibidores de COX-2 en estos pacientes. Sin embargo, la demostración de un incremento de eventos cardiovasculares graves tales como infarto del miocardio y accidentes cerebrovasculares con la administración prolongada de coxibs(24), ha constituido un importante revés en el manejo de los enfermos con hipersensibilidad a los AINEs. En la actualidad no está claro si estos eventos adversos también ocurren en pacientes expuestos en forma crónica a AINEs clásicos (naproxen), pero una aproximación razonable es la de evitar el uso de los coxibs que todavía están disponibles en el mercado (celecoxib y etoricoxib) en pacientes que portan o se encuentran en riesgo de sufrir cardiopatías, y utilizarlos para analgesia y disminución de la inflamación en individuos sin riesgo cardiovascular, y exclusivamente durante períodos cortos de tiempo. No se conoce aún si la decisión final de las autoridades reguladoras de los medicamentos será prohibir en forma absoluta el uso de coxibs o se limitará a la colocación de mensajes de advertencia dirigidos a pacientes y médicos acerca de los riesgos cardiovasculares de dichos medicamentos.
Debemos finalmente mencionar que a pesar de que las moléculas de coxibs que contienen sulfonamida en su estructura (celecoxib y valdecoxib) no parecen inducir con una alta frecuencia reacciones cutáneas comunes tales como urticaria y angioedema, si parecen producir las reacciones más graves típicas de las sulfas, especialmente síndrome de Stevens-Johnson y necrólisis epidérmica tóxica(16).