DIRECCIÓN: Dr. Abrahan Krivoy. Edificio Anexo B, Centro Médico de Caracas, San Bernardino, Caracas.
email: [email protected]
Servicio de Neurocirugía. Hospital Universitario de Caracas. Hospital Privado “Centro Médico de Caracas”. Caracas.
El trauma encefalocraneano ocupa el cuarto lugar en nuestras estadísticas de morbilidad y mortalidad según el Ministerio de Salud y constituye la primera causa de muerte por debajo de los 45 años. La medicina basada en evidencias ha producido cambios en los paradigmas terapéuticos reduciendo los aspectos intuitivos y la experiencia clínica no sistematizada a una dependencia de la fisiopatología y las pruebas que estos nuevos conocimientos producen. De ello derivaría la orientación terapéutica.
El monitoreo de presión intracraneana, si bien es cierto no ha producido aún una definición favorable en los comas agudo según la medicina basada en evidencia, el aporte reciente de los conocimientos de la fisiopatología y las terapéuticas recientes ha motivado a los centros de atención del trauma a un uso mayor del monitoreo en los llamados casos graves con la meta de poder ayudar aún más a estos pacientes.
Palabras clave: Monitoreo de presión intracraneana, trauma craneano.
Head injury is today in place 4 in mortality and morbidity in our Health Ministry and the leading cause of death among people under the age of 45. Evidence-based medicine and physiopathological knowledge produced an improvement in the standard of care offered to these patient and a increasing use of monitoring under Glasgow 8. Different device of cranium monitoring were reviewed.
Key words: Intracraneal pressure monitorig, head injury.
Desde el punto de vista neuroquirúrgico deben establecerse las soluciones de las siguientes interrogantes: ¿Todo trauma craneano debe monitorearse?; ¿Cuántos tipos de trauma existen?; ¿Cuál es el factor decisivo de los traumas secundarios?; ¿Cuándo monitorear?; ¿Con qué monitorear?; ¿Dónde monitorear?
Recordar que los traumatismos craneo-encefálicos representan la primera causa de muerte en la población debajo de 45 años de edad.
Para una mejor comprensión de los pasos a realizar, el desarrollo de los siguientes aspectos básicos contribuyen a resultados adecuados: medicina basada en evidencia; Monro-Kelli y volúmenes intracraneanos; curva volumen-presión; hernias cisternales; presión de perfusión-LCRCirculación cerebral; auto-regulación.
En 1747 el cirujano naval James Lind a bordo de H:M:S: Salisbury administraba a los marineros con escorbuto naranjas, sidras, limones, vinagre, nuez moscada y otros productos. A los 6 días después notó que los marineros que ingirieron cítricos se curaron del escorbuto que era el azote de los marinos en trayectos largos. Los otros marinos no obtuvieron la curación(1).
Desde 1996 10 expertos mundiales en neurotrauma en conexión con grupos de la especialidad clasificaron la totalidad de experiencia comunicada en 3 grupos: I Standard: incluye sólo a estudios amplios, prospectivos, aleatorizados, controlados y completos. II Orientaciones: igual a lo anterior, menos riguroso, acepta trabajos amplios no aleatorizado. III Opciones: estudios individuales, cohortes, casos anecdóticos, pequeñas experiencias. Ejemplos de los resultados de esta experiencia: I Standard: 1. Los anticonvulsivos profilácticos no deben usarse (fentoína, fenobarbital, carba-macepina). 2. No deben usarse los glucocorticoides para reducción de hipertensión endocraneana. 3. En ausencia de hipertensión endocraneana no debe usarse la terapia de hiperventilación prolongada (PaCO2<25 mmHg).
Según el Traumatic coma data Bank se define: “trauma cráneoencefálico grave son los de Glasgow 8 o menos dentro de las primeras 48 horas del accidente y después de las maniobras de reanimación no quirúrgicas (soporte hemodinámico, manitol, etc.)”(2).
Frecuencia del trauma encefalocraneano: representan la primera causa de muerte en la población debajo de 45 años de edad.
Frecuencia de hipertensión endocraneana en traumas severos: 53 %, al 63 % con TAC anormal y 13 % con TAC normal.
Durante 10 a 50 milesegundos del inicio del trauma se produce una onda hipertensiva entre 1 000 a 4 000 Torr que suele alterar la barrera hemato-encefálica del tallo cerebral.
Doctrina Monro-Kelly (1783-1823): el volumen cerebral se encuentra en una caja rígida (cráneo). La modificación de alguno de sus componentes causa cambios recíprocos en los otros.
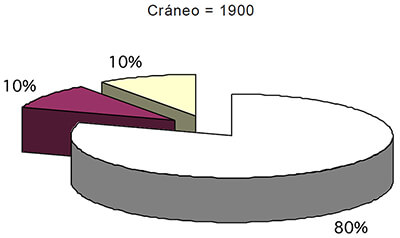
Volumen total intracraneano (1 900 cm3:= tejido cerebral 80 % + volumen sanguíneo 10 % + LCR 10 % + X.
Las variaciones del volumen de algún compartimiento intracraneano pasa por: I.- Mecanismos compensatorios óptimos. II.- Período de compensación espacial. III.- Período de descompensación espacial (Figura 1).
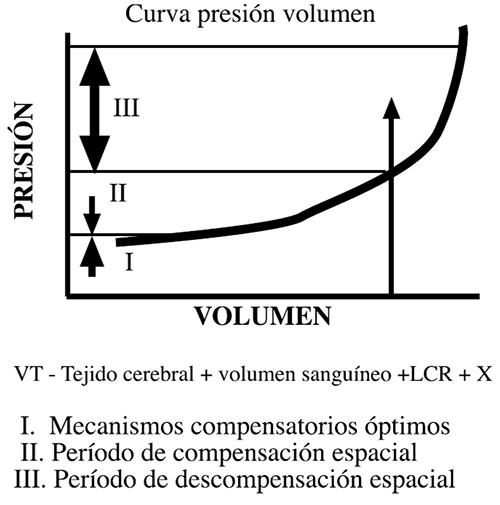
Traslado de LCR de los ventrículos o espacio subaracnoideo al espacio tecal espinal; aumento de reabsorción de LCR; reducción del volumen sanguíneo intracraneal: colapso venoso y contracción arteriolar (15-70 mL).
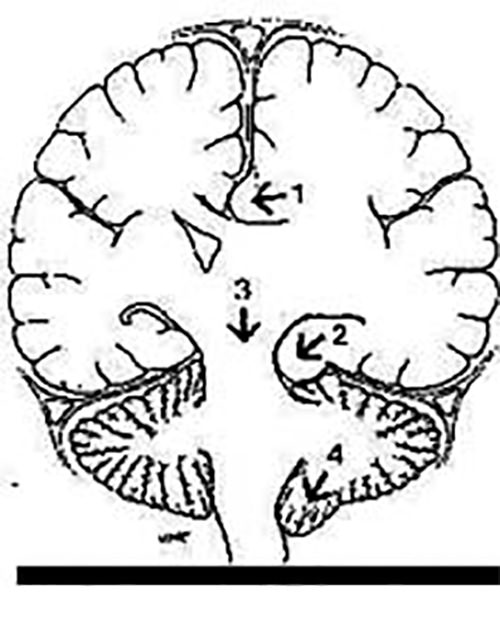
Herniaciones cisternales: desplazamiento anormal del tejido encefálico debido a vectores de presión que conducen a compresión de estructuras nerviosas y vasculares con el consecuente deterioro clínico. Por su topografía se clasifican en: sub-falciforme, uncal, central transtentorial, amigdalina y vermiana (Figura 2).
El otro de los conceptos básicos es el de presión de perfusión cerebral (PPC), que corresponde a la diferencia entre la presión arterial media (PAM), menos la presión intracraneana (PIC). Su valor debe ser mayor de 60 mmHg. PPC=PAM-PIC.
La presión intracraneana normal varía según la edad: en adultos va entre 10 a 15 mmHg. En niños oscila entre 3 a 7 mmHg. Lactantes entre 1,5 a 7 mmHg. Recordar que 1 mmHg (Torr) = 1,36 cm H2O y que 1 cm H2O = 0,735 mmHg (Torr)(3).
El LCR posee volumen total igual a 150 cm3. El volumen intraventricular oscila entre 20 a 30 cm3. La tasa de producción es de 0,35 mL/min. El 80 % se origina en el plexo coroide, 10 % a 20 % intraparenquimatoso. La producción es independiente de la presión intracraneana. La reabsoción es presión dependiente.
En relación con la circulación cerebral el volumen sanguíneo intracraneal es de 200 cm3, mayormente ubicado en las venas piales y senos durales quienes carecen de paredes musculares, son compresible con los cambios de presión.
En cuanto al flujo sanguíneo cerebral por el cerebro circulan 750 cm3/min. Por la sustancia gris, 75 a 80 cm3/100 g/min. Este flujo es calculable por la ley de Poiseuille que establece que el flujo = pr 4/8 nl., donde de 50 a 55 cm3 es normal; de 20 a 25 cm3 hay alteración de conciencia y del EEG. Entre 18 a 20 cm3 se produce coma y EEG plano. Entre 12 a 17 cm3 hay pérdida de evocados, falla de la bomba Na/K. Entre10 a 12 cm3 muerte celular en minutos.
La jerarquía de cerebro: se destaca porque es el 2 % del peso corporal y posee 20 % gasto cardíaco y 20 % del oxígeno. No existe un signo clínico que mida el flujo sanguíneo cerebral hasta que este se acerca a un daño irreversible.
El concepto de auto-regulación está dado por mecanismo por el cual grandes variaciones en la presión arterial sistémica producen pequeños cambios en el flujo sanguíneo cerebral. La disminución de la PPC por debajo de 40 mmHg hace que la autorregulación falle y el flujo sanguíneo cerebral disminuya.
Solo los graves que se definen con Glasgow menores de 8, dentro de las primeras 48 horas tras la reanimación cardiopulmonar no quirúrgica (soporte hemodinámico, manitol, etc.) y una TAC anormalhematomas, contusiones, edema o compresión de cisternas basales. También se debe monitorear el trauma grave con TAC normal pero con edad mayor de 40 años, postura motora uni o bilateral y presión arterial sistólica menor de 90 mmHg.
Hipertensión endocraneana se define como valores mayores 20 mmHg y que dure no menos de dos minutos o más.
Debido al confinamiento del lóbulo temporal la herniación del uncus puede producirse con presión intracraneana normal.
Trauma cerebral primario: inmediata al impacto y comprende contusiones en parénquima, hematomas extra-axiales y daño axonal difuso.
Trauma cerebral secundario se producen en horas o días después y comprende isquemia, inflamación, excitoxidad y lesiones metabólicas.
La isquemia cerebral corresponde al trauma secundario de mayor significación producida por la hipertensión endocraneana, presente en el trauma cerebral en forma inequívoca.
El patólogo Graham halló 91 % de los fallecidos por trauma isquemia encefálica. Diez años más tarde observaron que la isquemia seguía presente en 88 % de los fallecidos entre 1981-82 destacándose que todos los avances del cuidado preshospitalarios y de UCI no cambiaran para nada los efectos. Ataca más el hipocampo y ganglios basales, zonas fronterizas corticales entre arteria cerebral media y cerebral anterior.
Estas áreas son más frecuentes en los que sufrieron hipotensión arterial, hipoxia e hipertensión endocraneana. Las isquemias son el origen de las dos cascadas conocidas la de los radicales libres y liberación de aminoácidos excitotóxicos. Ambas son extremadamente lesivos al sistema nervioso.
Las lesiones secundarias generan cascada bioquímicas en el impacto por liberación de aminoácidos excitóxicos, radicales libres y otros que dentro del concepto de ventana terapéutica da expectativas futuras para desarrollar la cerebroprotección. La ventana terapéutica es el factor temporal que transcurre desde el inicio del trauma y el desarrollo del trauma secundario, ofrece la posibilidad de una terapéutica que inhiba el factor deletereo.
El insulto primario deja neuronas en penumbra, células enfermas pero no muertas. El insulto secundario si no se evita, las destruye.
¿Cómo manejar la isquemia del trauma secundario que es factor más decisivo?
Se realiza con la presión de perfusión que se define como la diferencia entre la presión arterial media menos la presión del LCR. La PP define los gradientes de presión que maneja el flujo cerebral y factores metabólicos que están directamente relacionados con la isquemia.
El vasoespasmo se ha venido evidenciando en estudios documentados, con aumento de la resistencia periférica que influyen sobre la presión y los factores metabólicos. Una baja de la PP empeora áreas isquémicas pre-existentes. El aumento de la presión hidrostática intravascular que sube la PP mejora del flujo.
Hipertensión intracraneana: la presión intracraneana en el adulto se considera normal debajo de 20 a 25 mmHg. Se considera fatal de 30 mmHg o más.
Monitoreo de presión intracraneana: debe ser fiable, de bajo riesgo para el paciente, que la variable monitorizada influya en el pronóstico, mejore los resultados de pacientes tratados, no debe ser oneroso.
Causas de hipertensión intracraneana: traumatismos, edema, hiperemia, hematomas, hidrocefalias, tumores, hipoventilación, trombosis de senos venosos y maniobra de Valsalva.
En el TCE, que representa la primera causa de muerte por debajo de los 45 años edad, la isquemia cerebral causada por la hipertensión endocraneana (HEC), por una reducción en la presión de perfusión cerebral (PPC) o secundarias a insultos sistémicos en la fase prehospitalaria (hipoxia, hipotensión o anemia) es la lesión secundaria de mayor prevalencia.
Trauma craneal severo (Glasgow = < 8 ptos); daños sistémicos múltiples con deterioro de conciencia y posterior a la remoción de masas intracraneanas. La tríada de Cushing comprende la hipertensión, bradicardia y trastornos respiratorios se suele encontrar en el 33 % de los traumas severos. Contraindicación del monitoreo en paciente consciente y portadores de coagulopatías.
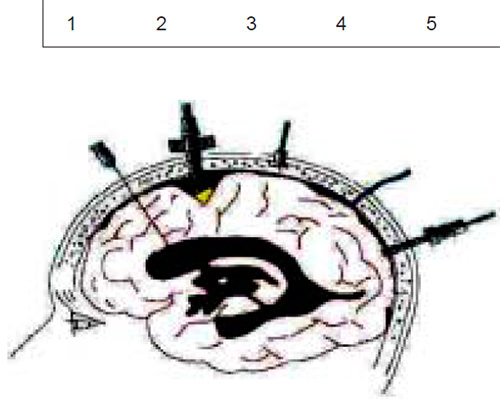
Intraparenquimatosos (Camino), tornillos subaracnoideo, subdurales, epidurales, ventriculares y transfontanelar(4).
Riesgo de infecciones 5 %-11 %. Debe tunelizarse para la reducción de infección y se sugiere su uso hasta 5 días.
Monitores epidurales: poco invasivo. Permite monitorizar más tiempo y bajo índice de infección. Se han comunicado variaciones de 2 mmHg mayor en espacio extradural en relación con el intraventricular. Monitores subdurales e intraparenquimatoso con fibra óptica (Camino): Alto costo, riesgo de infección y problemas en recalibración.
¿Cuál sistema de monitorización? El que mejor se domine. El que permita comprobar resultados.
Tipos de monitores; transductores acoplados con líquidos; transductores sin líquidos: por señales luminosas que pueden ubicarse en cualquier sitio - epidural, parénquima o ventrículo.
La intraventricular se considera estándar, es económica y puede drenar LCR cuando lo amerite. Se calibra en relación al Monro y debe recalibrarse cuando hay cambios posicionales. La cateterización del ventrículo es un obstáculo para su uso rutinario porque las diferentes etiologías distorsionan los ventrículos.
Dado a que existe gradientes entre los diferentes espacios encefálicos se ha demostrado diferencias hasta de 50 mmHg entre la región supratentorial e infratentorial en casos experimentales(5).
Lesiones difusas: el volumen de las lesiones en cualquiera de los dos hemisferios no superen los 25 mL por tomodensitometría y la desviación de la línea media no supera los 3 mm. Puede colocarse el monitor en cualquier sitio porque no hay compartimentalización.
Lesión focal: volumen de la lesión igual o mayor a los 25 mL y desplazamiento de la línea media mayor de 3 mm. Debe colocarse en el hemisferio donde se halla la lesión.
Tipos de ondas intracraneanas. Existen las ondas normales y las ondas patológicas que comprenden las siguientes: Lumdberg tipo A (Plateau). Elevaciones PIC> 50mmHg. Por 5-20 min. Acompañadas de aumento de la presión arterial. Se asocia a trastornos de la absorción del LCR.
Ondas patológicas.
Lundberg B: Amplitud de 10-20 mmHg, duración de 30 seg 1 min, las describió como de origen respiratoria, actualmente de origen vasomotor. Relacionada con hidrocefalia DVP?
Lundberg C: Baja amplitud, Frecuencia de 4-8 Hz. Se pueden ver sobre las ondas A y pueden ser pre terminales(6).
Tratamiento de HIC: Cabecera a 30˚; evitar la constricción de la yugular; evitar hipotensión (sistólica < 90 mmHg).
PCO2=35 - 40 mmHg. Sedación. Drenaje LCR 3-5 cm3. Manitol 0,25 – 1 mg/kg.
Metas del tratamiento: PIC < 20 - 25 mmHg. (Evitar ondas A). PPC > 70 mmHg. Medicina basada en evidencias o pruebas según Cochrane: (6), Cabecera a 30º, + aun cuando puede producirse una disminución de la presión arterial media en la carótida, la mejoría del retorno venoso disminuye la presión intracraneana, sin afectar la PPC.
Hiperventilación: el uso profiláctico empeora el resultado. Mantener PCO2 = 30-35 mmHg. (!PIC 30 %). PCO2<30 reducen flujo sanguíneo cerebral, no bajan más la presión intracraneana, pérdida de la autorregulación. PCO2 = vasoconstricción. Efecto: inicio 30 seg, pico 8 min, duración 20 min.
Esteroides: indicados en edema vasogénico (tumoral). Dexametasona 1 mg/kg carga, 0,25 mg/kg c/ 6 h, descontinuar a los 3 días si no hay mejoría. Corticoesteroides para lesión traumática aguda del cerebro (revisión de Cochrane). Alderson P. Roberts I. Conclusiones de los revisores: ni las ventajas moderadas ni los efectos dañinos moderados de esteroides pueden ser excluidos. La naturaleza extensamente practicable de las drogas y de la importancia del problema de salud sugiere que los ensayos simples grandes sean factibles, y de mérito, para establecer si hay algunas ventajas de corticoesteroides en esta situación. Citación: Alderson P, Roberts I. Corticosteroids para lesión traumática aguda del cerebro (revisión de Cochrane). En: La biblioteca de cochrane, Publica 2 2003. Oxford: Software De la Actualización.
Manitol: Expansión inmediata del plasma: disminución de hematocrito y viscosidad. Mejora la micro circulación. Efecto osmótico: atrae agua del parénquima. Efecto empieza a los 15-30 min, dura 1,5 - 6 h. La disminución PIC comienza a 1 - 5 min. Pico a los 20-60 min. Grandes dosis iniciales, disminuyen el efecto de las dosis menores posteriores. Usar mínima dosis efectiva, evita los picos de presión. (0,25 mg/kg q 2-3 h). Efecto sinérgico con la furosemida.
Precauciones manitol: pasa la barrera, empeora el edema, bolos v/s continuo. Esteroides + fenitoina + manitol puede producir estados hiperosmolares no cetónicos con alta mortalidad. Dosis altas = falla renal, osm. > 320m0sm/
Conclusiones de los revisores: el anti-epiléptico profiláctico es eficaz en la reducción de asimientos tempranos, pero no hay evidencia que el tratamiento con anti-epiléptico profiláctico reduce la ocurrencia de últimos asimientos, o tiene cualquier efecto en muerte e inhabilidad neurológica. La evidencia escasa está disponible para establecer la ventaja neta del tratamiento profiláctico en cualquier momento después de lesión.
Citación: Schierhout G, drogas de Roberts I. Antiepiléptico para los asimientos de prevención que siguen lesión traumática aguda del cerebro (revisión de cochrane). En: La biblioteca De Cochrane, Publica 2 2003. Oxford: Software De la Actualización.
Conclusiones de los revisores: no hay evidencia de ensayos controlados seleccionados al azar que la resucitación con los coloides reduce el riesgo de la muerte comparado a los cristaloides en los pacientes con trauma, quemaduras y después de cirugía. Pues los coloides no se asocian a una mejora en supervivencia, y pues son más costosos que cristaloides, es duro ver como su uso continuado en estos tipos pacientes se puede justificar fuera del contexto de ensayos controlados seleccionados al azar. Citación: Alderson P, Schierhout G, Roberts I, Bunn F. Coloides contra los cristaloides para la resucitación fluida en los pacientes críticamente enfermos (revisión de Cochrane). En: La biblioteca De Cochrane, Publica 2 2003. Oxford: Software De la Actualización. Resultados principales: No se han identificado ningunos estudios que resolvían los criterios de selección hasta la fecha.
Conclusiones de los revisores: no hay datos de los ensayos controlados seleccionados al azar que pueden clarificar el papel de ICP que supervisa en coma agudo. Citación: Forsyth R, Baxter P, presión intracraneal de Flliott t. Routine que supervisa en el coma agudo (revisión de Cochrane). En: La Biblioteca De Cochrane, Publica 2 2003. Oxford: Software De la Actualización.
Furosemida: pocos datos soportan su uso. Actúa sinérgico al manitol cuando hay ruptura de la barrera y pasaje intracelular del manitol 10-20 mg IV q 6 h.
Pentotal: vasoconstricción. Disminución de la demanda metabólica, captador de radicales libres, estabilización lisosomas. Produce hipotensión por disminución tono simpático, por vasodilatación (50 % pacientes). Pérdida del examen neurológico. Dosis: 5 mg/kg IV en 10 min, 5 mg/kg / h x 24 horas y mantenimiento: 2,5 mg/kg/h.
Tratamiento quirúrgico: evacuar epidurales o subdurales >1 cm. Hemorragias intraparenquimatosas con deterioro neurológico progresivo. Lesiones focales accesibles de más de 25 cm3. Craniectomías descompresivas. Lobectomías.
No perder el panorama global del paciente. El árbol tapa al bosque, por lo que el método debe ser individualizado y acompañarse de los otros monitoreos sistémicos, imaginológicos, químicos, etc.
No olvidar que la hipertensión endocraneana produce isquemia y que el monitoreo vascular se impone.
Neurosis: ausencia de abstracción de desarrollo conceptual (el árbol no deja ver el bosque). Desarrollo conceptual de la capacidad de abstracción, compresión global del problema y consecuente curación.
Nuevas contribuciones al conocimiento del trauma: trauma estereotáctico. Biomecánica tridimensional. Estereotáctica traumática.
La relación entre cráneo y cerebro es aproximadamente esférica. El fenómeno de aceleración puede ser lineal o rotacional en alta energía
Biomecánica tridimensional. Estereotáctica traumática. En baja y media energía se generan vibraciones que aumentan hacia las profundidades craneanas concurriendo a su centro geométrico.
Trauma estereotáctico.
Biomecánica tridimensional estereotáctica traumática.
El trauma axonal difuso experimental entre perro y mono resulta en el perro mucho más bajo en el tallo cerebral y en los primates en la parte alta por la forma del cráneo.
Biomecánica tridimensional estereotáctica traumática.
Esta concepción estereotáctica explica mejor los signos y las lesiones postraumáticas encefálicas así como la patología de los boxeadores en su encefalopatía crónica y formas de Alzheimer.
Lesión axonal difusa: ocurre cuando los axones son estirados y torcidos durante el trauma y produce muerte neuronal y daño clínico importante sin hipertensión endocraneana. Inicialmente considerada como lesión primaria porque suele estar presente en el momento del trauma, se ha demostrado que requiere horas para su final consolidación y dentro de la ventana terapéutica existe un posible potencial.
No todos los que chocan con un conductor ebrio mueren.... La muchacha que hace esta cuña es la “modelo” original y es venezolana. El que sube al auto de un conductor que haya bebido es igual de tonto e irresponsable que el conductor.
Aun cuando no hay estudios aleatorizado y prospectivo existe un conjunto de experiencias clínicas que afirman que: Es una ayuda en detección precoz de lesiones expansivas. Limita el uso indiscriminado de terapias para el control de la hipertensión que en esas dosis son deletereas. Drenar el LCR mejora la perfusión cerebral. Ayuda a mejorar el pronóstico. Mejora el resultado clínico.
Lo anterior ha hecho difundir su uso en centros hospitalizado con bajo riesgo y algunos de bajo costo si se toma en cuenta las secuelas que pueden quedar de no hacerlo. Algunas bibliografías nacionales sobre el tema se citan(8-12).
Politrauma: el éxito del manejo de un politraumatizado es un esfuerzo interdisciplinario donde la inmediata cooperación del equipo de emergencia es mandatorio. El mejor tratamiento del trauma es su profilaxia.